生物医药行业注意!11月新规来临!
2022-11-05发表步入11月份,一批新规也都落地实施,以下是医药行业相关的政策法规。
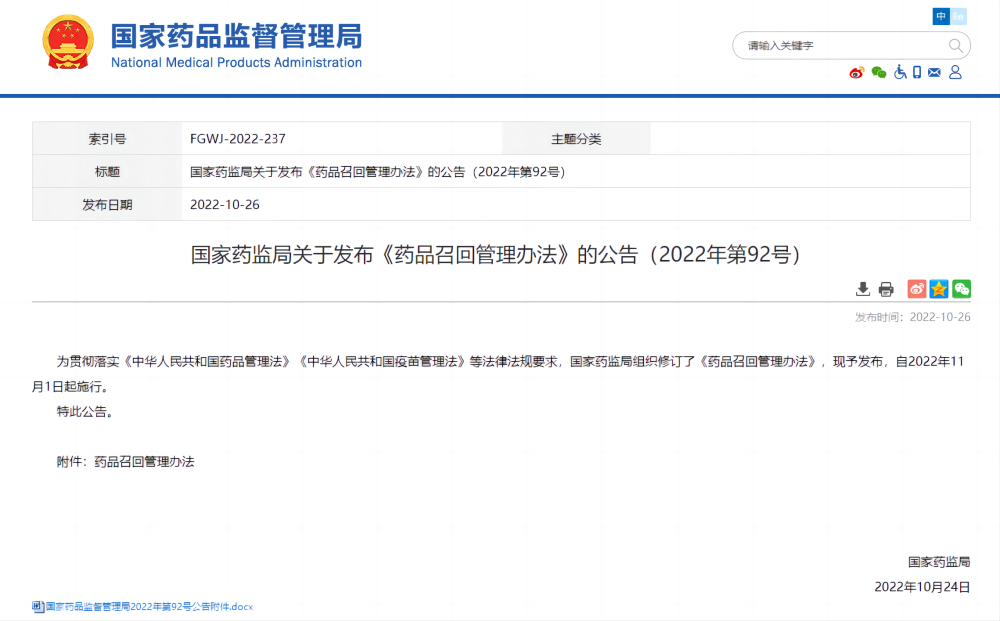
药品召回管理办法完善
药品召回制度是药品上市后安全监管的一项风险管理措施,是针对存在质量问题或者其他安全隐患药品的一种风险管理措施,通过将市场上可能具有潜在危及人体健康风险的药品进行收回或采取矫正措施,将药品可能对公众造成的潜在不良影响最小化,避免质量问题或者安全隐患扩散而产生更大的危害。原《办法》于2007年12月由原食品药品监督管理局发布,实施10余年来,为及时有效加强药品安全风险管理发挥了积极作用。
近年来,随着新修订《药品管理法》和新制定《疫苗管理法》实施,药品上市许可持有人(以下称持有人)制度落地,药品监管要求发生了很大变化。为进一步加强药品质量监管,强化药品风险管理,落实持有人主体责任,保障公众用药安全,需对药品召回及其管理工作进行修订完善。
新修订的《药品召回管理办法》自2022年11月1日起施行,完善召回药品处理措施,明确了召回药品标识、存放措施等应当与正常药品明显区别,防止差错、混淆;对需要销毁的,应当在持有人、药品生产企业或者储存召回药品所在地县级以上人民政府药品监管部门或者公证机构监督下销毁;对可以通过更换标签、修改并完善说明书、重新外包装等方式消除隐患的,可以适当处理后再上市。
医疗器械电子注册证实施
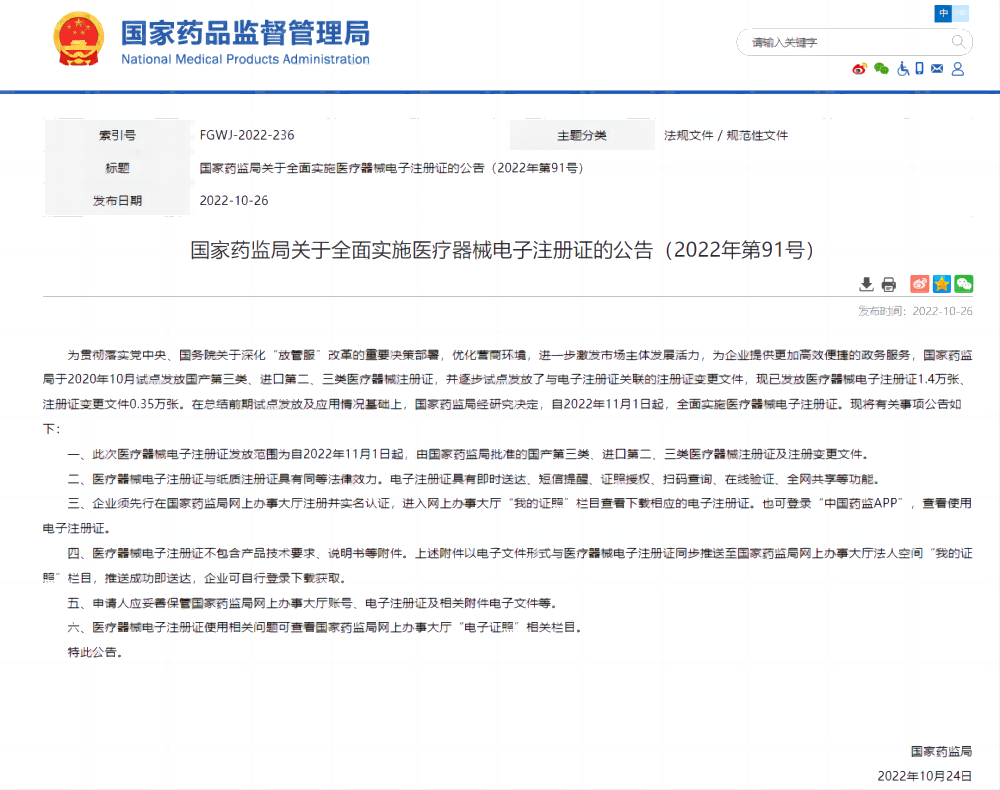
为贯彻落实党中央、国务院关于深化“放管服”改革的重要决策部署,优化营商环境,进一步激发市场主体发展活力,为企业提供更加高效便捷的政务服务,国家药监局于2020年10月试点发放国产第三类、进口第二、三类医疗器械注册证,并逐步试点发放了与电子注册证关联的注册证变更文件,现已发放医疗器械电子注册证1.4万张、注册证变更文件0.35万张。在总结前期试点发放及应用情况基础上,国家药监局经研究决定,自2022年11月1日起,全面实施医疗器械电子注册证。
国家药监局发布《关于全面实施医疗器械电子注册证的公告》明确,此次医疗器械电子注册证发放范围为由国家药监局批准的国产第三类、进口第二、三类医疗器械注册证及注册变更文件。医疗器械电子注册证与纸质注册证具有同等法律效力,电子注册证具有即时送达、短信提醒、证照授权、扫码查询、在线验证、全网共享等功能。
关于第三类医疗器械,汇智泰康可以提供以下几个方面的服务:
- SPF清洁级动物房搭配使用,满足不同试验要求
- 医疗器械生物学评价(试验依据:GB/T16886)
- 组织病理研究服务
- 临床病理服务
- 医疗器械及生物医学材料成分、组织与结构分析
- 生物学评价生物样品分析
- 其它技术咨询服务
关于药物研究,汇智泰康可以提供以下几个方面的服务:
- 小分子成药性研究
- 药代动力学-支持IND/NDA申报
- 生物大分子药物早期发现
步入11月份,一批新规也都落地实施,以下是医药行业相关的政策法规。
药品召回管理办法完善
药品召回制度是药品上市后安全监管的一项风险管理措施,是针对存在质量问题或者其他安全隐患药品的一种风险管理措施,通过将市场上可能具有潜在危及人体健康风险的药品进行收回或采取矫正措施,将药品可能对公众造成的潜在不良影响最小化,避免质量问题或者安全隐患扩散而产生更大的危害。原《办法》于2007年12月由原食品药品监督管理局发布,实施10余年来,为及时有效加强药品安全风险管理发挥了积极作用。
近年来,随着新修订《药品管理法》和新制定《疫苗管理法》实施,药品上市许可持有人(以下称持有人)制度落地,药品监管要求发生了很大变化。为进一步加强药品质量监管,强化药品风险管理,落实持有人主体责任,保障公众用药安全,需对药品召回及其管理工作进行修订完善。
新修订的《药品召回管理办法》自2022年11月1日起施行,完善召回药品处理措施,明确了召回药品标识、存放措施等应当与正常药品明显区别,防止差错、混淆;对需要销毁的,应当在持有人、药品生产企业或者储存召回药品所在地县级以上人民政府药品监管部门或者公证机构监督下销毁;对可以通过更换标签、修改并完善说明书、重新外包装等方式消除隐患的,可以适当处理后再上市。

医疗器械电子注册证实施
为贯彻落实党中央、国务院关于深化“放管服”改革的重要决策部署,优化营商环境,进一步激发市场主体发展活力,为企业提供更加高效便捷的政务服务,国家药监局于2020年10月试点发放国产第三类、进口第二、三类医疗器械注册证,并逐步试点发放了与电子注册证关联的注册证变更文件,现已发放医疗器械电子注册证1.4万张、注册证变更文件0.35万张。在总结前期试点发放及应用情况基础上,国家药监局经研究决定,自2022年11月1日起,全面实施医疗器械电子注册证。
国家药监局发布《关于全面实施医疗器械电子注册证的公告》明确,此次医疗器械电子注册证发放范围为由国家药监局批准的国产第三类、进口第二、三类医疗器械注册证及注册变更文件。医疗器械电子注册证与纸质注册证具有同等法律效力,电子注册证具有即时送达、短信提醒、证照授权、扫码查询、在线验证、全网共享等功能。

关于第三类医疗器械,汇智泰康可以提供以下几个方面的服务:
- SPF清洁级动物房搭配使用,满足不同试验要求
- 医疗器械生物学评价(试验依据:GB/T16886)
- 组织病理研究服务
- 临床病理服务
- 医疗器械及生物医学材料成分、组织与结构分析
- 生物学评价生物样品分析
- 其它技术咨询服务
关于药物研究,汇智泰康可以提供以下几个方面的服务:
- 小分子成药性研究
- 药代动力学-支持IND/NDA申报
- 生物大分子药物早期发现


